Editoriale
Evidence 2013;5(1): e1000032 doi: 10.4470/E1000032
Pubblicato: 28 gennaio 2013
Copyright: © 2013 Chalmers. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Vedi anche: Occultare i risultati dei trial clinici rappresenta la violazione di un obbligo scientifico, etico e morale
Negli ultimi 20 anni numerose evidenze hanno documentato le distorsioni dovute al reporting insufficiente e inadeguato della ricerca (under-reporting) (1-4), inquietante fenomeno che rappresenta una grave negligenza nella conduzione della ricerca e determina serie conseguenze (5,6). Infatti, l’under-reporting sovrastima l’efficacia e sottostima gli effetti avversi dei trattamenti (7), espone i pazienti a rischi evitabili e determina spreco di risorse destinate all’assistenza sanitaria.
Gran parte delle critiche si sono legittimamente concentrate sulle sperimentazioni finanziate dall’industria, sia perché questa sponsorizza la maggior parte dei trial in tutto il mondo, sia perché esistono consistenti e inequivocabili evidenze di under-reporting, oltre che di manipolazione della letteratura, da parte dell’industria farmaceutica e biomedicale (4). Tuttavia il fenomeno dell’under-reporting non è confinato ai trial finanziati da sponsor commerciali, tanto che i primi esempi di mancata pubblicazione di risultati negativi vengono proprio dal mondo accademico (5,8). Né si può dire che nei decenni successivi accademia e ricercatori abbiano fatto qualcosa in più dell’industria per migliorare la propria condotta.
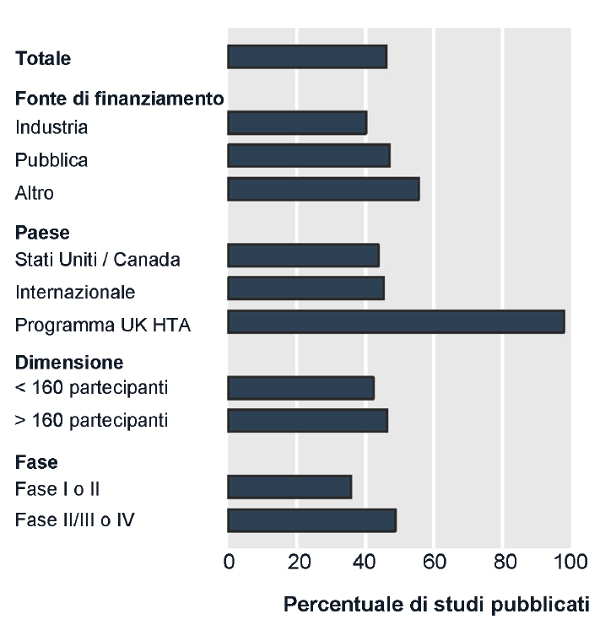
Oggi, grazie alla registrazione dei trial, è possibile stimare l’entità dell’under-reporting e descriverne alcune caratteristiche. Solo per la metà dei trial registrati (figura) esiste una pubblicazione, almeno parziale, dei risultati, e questo riguarda tutti i tipi di trial: dalla fase I alla fase IV, di piccole e grandi dimensioni, nazionali e internazionali, finanziati dall’industria e non (9).
La mancata pubblicazione dei trial è una problematica estremamente rilevante perché i partecipanti sono convinti di contribuire al progresso della medicina. Di conseguenza, l’under-reporting contraddice questo ragionevole presupposto, tradisce chi si è volontariamente arruolato in un trial e viola il patto sottoscritto nel consenso informato.
Inoltre, la mancata pubblicazione di tutti i risultati dei trial determina una distorsione delle evidenze scientifiche su cui basare le decisioni cliniche. In un Personal View pubblicato otto anni fa su BMJ, Alessandro Liberati - epidemiologo clinico - lamentava il fatto che alcuni risultati di trial non pubblicati avrebbero potuto informare le sue scelte di paziente affetto da mieloma multiplo. “Perché sono stato costretto a prendere le mie decisioni sapendo che da qualche parte esistevano evidenze non disponibili al pubblico? Il ritardo nella pubblicazione è dovuto al fatto che i risultati erano meno interessanti del previsto? Oppure perché la ricerca sul mieloma, costantemente in evoluzione, guarda sempre a nuove e più stimolanti teorie (o farmaci)? Quanto possiamo ancora tollerare l’atteggiamento “farfallino” dei ricercatori, che volano verso un nuovo fiore prima di avere completamente “assaporato” quello precedente?” (10)
Il 1 gennaio 2012 Alessandro Liberati è morto per le complicanze della sua malattia, nella vana attesa che venissero pubblicate evidenze rilevanti per le sue opzioni terapeutiche.
Numerosi trial non sponsorizzati dall’industria non hanno mai pubblicato i loro risultati, tra cui studi rilevanti finanziati da prestigiose istituzioni. Ad esempio, un trial di grandi dimensioni sull’adenoidectomia finanziato dal Medical Research Council britannico è stato pubblicato solo nel 2012, ben dieci anni dopo la sua conclusione (11). E proprio in questo numero il BMJ riporta il caso di ricercatori accademici USA che non hanno pubblicato i dati relativi al follow-up di un trial sulla biopsia del linfonodo sentinella nel melanoma maligno, nonostante definiti dal protocollo (12).
Perché i trial finanziati dalle istituzioni non vengono pubblicati? Spesso, e in parte legittimamente, il dito è stato puntato contro le riviste, accusate di favorire il bias di pubblicazione accettando solo i trial con risultati positivi. Tuttavia le evidenze dimostrano che autori e sponsor sono i principali responsabili perché non inviano alle riviste i report per la pubblicazione (13). Se per i trial finanziati dall’industria è chiaro che i conflitti di interesse di natura finanziaria rappresentano il movente per occultare risultati sfavorevoli, quali ragioni spingono in questa direzione autori e sponsor non commerciali? Gli autori ammettono di rifiutarsi di scrivere e inviare contributi sui risultati ottenuti (14), e l’aneddotica suggerisce varie motivazioni: perdita di interesse, trasferimento in una nuova istituzione, avvio di nuovi progetti, organizzazione inadeguata, risorse limitate, blocco dello scrittore, mancata accettazione dei risultati negativi percepiti come un fallimento del proprio investimento intellettuale o lesivi della propria reputazione. In ogni caso, a fronte dei miliardi sprecati, non c’è stato alcun impegno sistematico per monitorare l’entità della mancata pubblicazione, e ancor meno per ricercarne le motivazioni.
Peraltro, sulle responsabilità degli autori la Dichiarazione di Helsinki non lascia spazio ad alcuna ambiguità: “gli autori hanno il dovere di rendere pubblicamente disponibili i risultati delle loro ricerche su soggetti umani e sono responsabili della completezza e dell’accuratezza dei loro report... I risultati negativi e quelli non conclusivi dovrebbero essere pubblicati, o resi comunque pubblicamente disponibili, analogamente a quelli positivi (15)”.
Purtroppo, è difficile che i ricercatori modifichino il loro atteggiamento senza un’azione risoluta da parte di chi fornisce l’approvazione etica o da chi offre il setting istituzionale e il supporto finanziario ai trial. In particolare, se da tempo ai comitati etici viene richiesto un comportamento “etico” in quanto garanti della pubblicazione dei risultati dei trial16, di fatto tali comitati si sono fatti notare per la loro latitanza, sia non segnalando i casi di under-reporting, sia non adottando alcuna azione specifica per prevenire il problema. La figura dimostra che le istituzioni hanno altrettante responsabilità con alcune lodevoli eccezioni: infatti, il 98% degli studi finanziati dal National Institute for Health Research Health Technology Assessment Programme ha portato alla pubblicazione di report completi (Ruairidh Milne, comunicazione personale). Questo risultato è stato ottenuto trattenendo una tranche del finanziamento sino all’avvenuto invio del report per la pubblicazione, sollecitando regolarmente gli autori e fornendo per tutti i trial un mezzo di pubblicazione, la rivista Health Technology Assessment.
Questo è un chiaro esempio di quali iniziative possono e dovrebbero essere intraprese. Attraverso la registrazione pubblica dei trial oggi è possibile identificare sponsor e istituzioni che perseverano in azioni di under-reporting. I pazienti invitati a partecipare ai trial dovrebbero valutare i “precedenti” di istituzioni e sponsor coinvolti, e rifiutarsi di partecipare senza una garanzia scritta che i risultati completi dello studio saranno resi pubblici e gratuitamente accessibili (box).
|
Box. Consigli ai pazienti invitati a partecipare a un trial clinico (17) Accettate di partecipare ad un trial clinico solo se: |
Questa settimana è stata lanciata la campagna AllTrials (alltrials.net), finalizzata a garantire che tutti i trial vengano registrati e tutti i loro risultati pubblicati o comunque resi pubblicamente disponibili.
Invitiamo tutti i lettori del BMJ a sottoscrivere la petizione AllTrials.